|
28.12.2006 Voda? Šta tu ima da se priča? Svi znamo o vodi sve što je bitno: da je to bezbojno hemijsko jedinjenje koje predstavlja osnovu svekolikog života na našoj planeti. U različitim formama ima je (da kažemo) 1,4 milijardi kubnih kilometara i pokriva bezmalo 70% Zemljine površine. Čak je otkrivena i u slobodnom kosmosu (doduše u vidu molekula), a relativno od skora i na nekim planetama (Marsu, Neptunu, Plutonu itd.) i njihovim satelitima (npr. Mesecu, Evropi, Titanu, Enceladusu itd.). I to je u glavnom to.
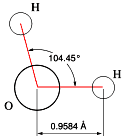
Da, ali samo za ljude koji se zadovoljavaju formom. Daj da malo podrobnije pogledamo o čemu se radi. Šta sve čini ovo u suštini prosto hemijsko jedinjenje tako izuzetnim i zašto ga baš svi tretiraju kao neizostavan faktor života. Kao i uvek, i ovde nam je najbolje da se oslonimo prvo na nauku. Molekuli vodi (H2O) su najrasprostranjeniji molekuli na Zemljinoj površini, bilo da se nalaze u tečnom ili čvrestom stanju, bilo da ih posmatramo kao sastojke naše atmosfere. Često kažemo da se na standardnoj temperaturi i pritisku [1] voda i njena para nalaze u stanju dinamičke ravnoteže. Na sobnoj temperaturi ova je tečnost bez boje, ukusa i mirisa. Puno se supstanci rastavara u vodi te je često doživljavamo kao univerzalni rastvarač, zbog čega se u prirodi retko sreće stvrno čista i može da ima donekle različita svojstva od onih u laboratoriji. S druge strane, ima puno jedinjenja koja su u suštini, ako ne i totalno, nerastvoriva u vodi. Voda je jedina prosta, čista supstanca koja se u prirodi može naći u sva tri stanja. Modifikacije voda se javlja u više vidova. Kada se nađe u čvrstom stanju, kažemo da je to led (kojih ima 14 vrsta), kada je u gasovitom, da je to vodena para, i kada je tečna, kažemo da je to obična voda. Iznad određene kritične temperature [2] i pritiska (647 K i 22,064 MPa odn. 220,64 bara odn. 218,76 atm), molekuli vode prelaze u superkritično stanje, u kome njihovi grozdovi čine nešto poput tečnosti, koja lebdi unutar ostatka molekula koji su u nekoj gasovitoj fazi.
Siguran sam da su svi čuli za "tešku vodu". Čak su i neki filmovi snimljeni o tome kako je za vreme II Svetskog rata, tačnije 1943. godine, šaćica norveških partizana uspela da uništi nemačke pogone za proizvodnju teške vode u Vemorku, i "tako spreči razvoj nacističke nuklearne bombe, čiji bi nastanak unazadio razvoj demokratije u vrlom novom svetu koji je na pomolu".
Šta ju je činilo tako vrednom? Pa to je hemijski obična voda, samo što su vodonikovi atomi zamenjeni njihovim težim izotopom, deuterijumom. Jeste, ali je zato teška voda u to vreme bila nezamenjiv neutronski usporavač u nuklearnim reaktorima, a bez njih – zna se – nema ni atomske bombe. Voda u vasioni Spektralnom analizom svetlosti koja stiže iz naše galaksije, nedvosmisleno je utvrđeno da molekula vode ima u međuzvezdanom gasu. Pošto se zna da su i vodonik i kiseonik među najrasprostranjenijim hemijskim elementima u vasioni, sigurno je da je voda široko rasprostranjena i u drugim galaksijama. Kondenzovanjem međuzvezdanog oblaka stvorene su solarne nebule i planetni sistemi, kao što je naš. Vodu možemo pronaći u kometama, velikim planetama i asteroidima (planetama patuljcima) i njihovim satelitima. Ta voda je skoro po pravilu u vidu leda, i sa sigurnošću možemo reći da je otkrivena na Mesecu, na planetama Merkuru, Marsu i Neptunu (i Plutonu) i na satelitima Tritonu, Eceladusu i Europi. Ima indicija da se na nekim satelitima velikih planeta voda nalazi u tečnom stanju (npr. na Enceladusu), pa čak i da ispod tankih kora od leda postoje veliki okeani tečne vode (npr. na Kalistu ili Evropi). Voda na Zemlji "Kruženje vode" (među naučnicima poznatiji kao hidrološki ciklus) označava kontinuirani proces razmene vode u hidrosferi, između atmosfere, površinske i podzemne vode, tla i biljnog sveta. Zapremina vode na Zemlji iznosi oko 1.355.500.000 km3. Od te zapremine: § 1.320.000.000 km3 čine okeani, § 25.000.000 km3 su glečeri i polarne kape, § 13.000.000 km3 se nalazi u tlu, § 250.000 km3 čine slatkovodni oblici (reke, jezera, kopnena mora itd.), § 13.000 km3 je atmosferska vodena para. Kao što se vidi, najveći deo vode se nalazi "zarobljen" u svetskim okeanima, ali je u oba agregatna stanja ima i u atmosferi i zemlji (akviferi). Tačka ključanja vode je u direktnoj vezi sa barometarskim pritiskom i dobija se direktno iz tzv. Clapeyronove formule. Po njij, dobićemo da na 0 metara nadmorske visine voda ključa na 100° C; na 1.000 m (pritisak oko 0,88 atm) ključa na 96,5° C; na 2.000m (pritisak oko 0,79 atm) na oko 93° C; na vrhu Mont Everesta na oko 67° C. Kvantna svojstva vode Mada se u molekularnoj termodinamici uzima zdravo za gotovo da je molekularna formula vode H2O, radovi koji su otpočeli 1995. godine pokazuju da bi subatomskom kvantnom nivou ta formula pre ličila na H3/2O [4]. To otkriće će svakako imati velikog uticaja na nivou, naprimer, vodoničnih veza u biološkim, hemijskim i fizičkim sistemima. Eksperimenti koje je obavljao Aris Chatzidimitriou-Dreismann sa Tehničkog univerziteta u Berlinu pokazuju da se prilikom sudara sa molekulima vode neutroni i protoni odbijaju u takvom odnosu koji nagoveštava da je odnos vodonika i kiseonika 1,5:1 (3/2:1). Međutim, te reakcije se dešavaju na vremenskom nivou koji se izražava atosekundama (10–18 sec), što znači da su relevantne samo kod dinamičkih i kinetičkih sistema. M'pemba efekat Pod određenim uslovima, primećeno je da vruća voda može da se zaledi pre nego hladna, iako treba da pređe veći temperaturni raspon! To je 1963. godine sasvim slučajno primetio jedan srednješkolac iz Tanzanije, radeći kao privatni sladoledžija. Iako svima izgleda nelogično, efekat se može objasniti efektima koji prate svako zaleđivanje: isparavanjem, prehlađivanjem, strujanjem i izolacijom. Koga interesuje više detalja o ovome, može da pročita u knjizi "Molim te objasni mi" koju je još jedno vreme moguće naručiti i preko sajta www.astronomija.co.yu. Hot Ice Vrući led je naziv za još jedan iznenađujući fenomen u kome se na sobnoj temperaturi voda može da pretvori u led i da ostane tako uz pomoć električnog polja od oko 106 volti po metru. Eksperimenat je prvi put izveo Eun–Mi Choi sa univerziteta u Seulu. Efekat takvog električnog polja se uzima za objašnjavanje nastanka oblaka. Kada se oblak prvi put formira oko čestica pračine, potrebna je temperatura od –10° C, ali sledeće leđenje oko iste čestice prašine zahteva temperaturu od samo –5° C, sugerišući neku vrsti "memorije leda" [5].
(25.03.2007.)
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||